Activités
documentaires et expérimentales Notion de pression
I.
LES GAZ A L’ECHELLE MICROSCOPIQUE
1-1
Expérience :
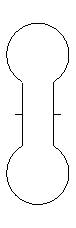
diffusion de gaz entre deux
ballons doc.3 p 276
Le dioxyde
d’azote est un gaz roux.( gaz observé sous hotte lors
de la première expérience du TP sur l’élément cuivre, attaque du cuivre
métallique par l’acide nitrique )
Observer les 2 ballons sur le film du CD
de votre livre : que contiennent-ils ? Faire un schéma.
Les 2 ballons sont ensuite mis en communication. Noter les
observations. schéma
Le gaz coloré occupe l’ensemble
des deux ballons, il y a mélange des deux gaz : l’air et le gaz roux.
1-2 Interprétation :
le mouvement brownien* ( doc. 4 p 277 )
de Robert
Brown botaniste anglais ( 1773-1858)
Ce chercheur a observé en 1827 au microscope des grains de
pollen en suspension dans l’eau, il remarqua que les grains avaient des
mouvements désordonnés alors que l’eau paraissait immobile, par extension on
parle de mouvement brownien pour un mouvement rapide et désordonné
.
Les gaz sont constitués de molécules très petites et très
éloignées en moyenne les unes des autres par rapport à leurs dimensions propres
et se déplaçant à très grande vitesse ( par exemple
une molécule de dioxygène ou de diazote
de l’air de la salle de classe se déplace à une vitesse moyenne d’environ
On peut aussi observer le mouvement brownien des molécules en
observant des grains de poussière en suspension dans l’air dans un rai de
lumière, la poussière est bousculée par les molécules d’air.(
mais les particules de poussières,
beaucoup plus lourdes que les molécules de l’air se déplacent beaucoup moins
vite)
|
En étudiant le document 4 p
277 : dessiner un exemple de trajectoire d’une molécule prise
parmi les milliers de milliards de milliards de molécules contenues dans
l’ensemble des deux ballons reliés par leur col de l’expérience précédente
donner une explication à l’expérience précédente : La distance moyenne parcourue entre 2
chocs est de l’ordre du dixième de micromètre et chaque molécules d’air subit
environ 100 millions de collisions par seconde. C’est l’agitation des molécules qui
provoque le mélange des gaz. Les molécules sont en mouvement incessant, rapide
et désordonné en toute direction.. Par chocs
successifs entre elles et sur les parois, elles se répandent dans l’ensemble
du volume qui leur est offert. Quelle est la propriété des gaz mise en évidence ? un gaz est expansif |
|
photocopie
I.
LES FORCES PRESSANTES. NOTION DE PRESSION.
« Rien ne fait mieux
connaître l’air que là où il n’est pas » disait.Fontenelle
au XVIIème siècle.
C’est un
académicien qui s’intéressa entre autre à l’astronomie, il fut membre de
l’académie française en 1691 et de l’académie des sciences en 1697 (« Entretiens sur la pluralité des mondes )
2-1
Expériences
·
Expérience
des hémisphères de  Magdebourg ‘ schéma plus grand à la page 275 de votre livre )
Magdebourg ‘ schéma plus grand à la page 275 de votre livre )
En
1654, une expérience importante fut menée à Magdebourg par Otto Von Guericke.
Il utilisa deux hémisphères qu'il accola de manière à ce que le joint soit
étanche, puis il fit le vide dans la sphère ainsi réalisée. Il fallut 8 chevaux
tirant sur chaque hémisphère (soit 16 au total) pour les décoller (voir doc.
ci-contre).
Les
deux hémisphères forment une sphère de rayon
R =
Expérience
similaire avec deux petits hémisphères ( rayon
d’environ
Dispositif complet : sphère percée, pompe à vide …
Pourquoi les deux
hémisphères restent-ils accolés lorsque nous faisons le vide?
Chaque élément de
surface de la paroi est à chaque instant, bombardé par les molécules de l’air,
quand on retire l’air de l’intérieur de la sphère, le bombardement n’existe
plus que sur la paroi extérieure de la sphère, ce qui colle les deux
hémisphères.
D’où la citation
précédente, on voit mieux l’action de l’air sur les parois quand on compare avec
le cas où il est absent.
 Il y a de l’air à l’extérieur mais pas à
l’intérieur.
Il y a de l’air à l’extérieur mais pas à
l’intérieur.
·
Expérience
du crève-vessie
 Observation : la
membrane se déforme de plus en plus lorsqu’on fait le
Observation : la
membrane se déforme de plus en plus lorsqu’on fait le
vide à l’intérieur
et finit par éclater avec un grand bruit
lorsque le vide est
assez poussé.
On observe ainsi l’effet de l’air
extérieur sur la feuille de cellophane.
.Interprétation :
les chocs des molécules de
l’air extérieur sur la
membrane sont
plus nombreux que ceux des molécules
de l’air
raréfié du récipient.
Avant de pomper de l’air du récipient, les actions exercées par
l’air de part et d’autre sur la membrane s’équilibrent, puis l’action de l’air au dessus devient
prépondérante, déforme la membrane qui peut éclater.
·
Expérience
à laide d’une cloche à vide :
Nous utilisons deux
montages identiques : une éprouvette remplie à moitié et renversée dans un
bécher, un montage est laissé à l’air libre et l’autre est placé sous une
cloche où nous allons faire un vide partiel,

En servant des résultats
précédents, compléter le second schéma, vérification par l’expérience.
L’action de l’air enfermé dans l’éprouvette est prépondérante
, elle pousse davantage sur l’eau de l’éprouvette que l’air raréfié sur
la surface libre de l’eau du bécher : l’eau passe de l’éprouvette dans le
bécher.
Conclusion : Un gaz exerce une force pressante sur les parois du récipient
qui le contient. Cette force est toujours perpendiculaire à
2-2
Définition de la pression
on vient de voir que les gaz exercent une force
pressante sur les parois des récipients qui les contiennent, pour mieux définir
la pression, nous allons prendre un exemple simple où un homme exerce une force
pressante sur la neige, une force pressante pouvant aussi être exercé par un
solide
Un homme marche en chaussures dans la neige fraîche,
il s’enfonce ; s’il chausse des raquettes, il s’enfonce beaucoup moins,
proposer une explication puis choisir entre les formules ci-dessous celle
qui traduit les observations faites.( p désigne
la pression, s : la surface et F : la force pressante.)
p = F.s p = F + s p = ![]()
L’enfoncement
dans la neige traduit la pression exercée par l’homme sur la neige.
L’homme s’enfonce davantage dans la neige
lorsque la force pressante qu’il exerce sur elle se répartit sur une plus
petite surface. Plus la surface de répartition de la force pressante est
faible, plus la pression exercée est grande.
|
F en newton (N) S en .m² p en pascals (Pa) |
p = |
|
L’effet des innombrables
chocs des molécules de gaz sur les parois est une force exercée par le gaz,
elle tend à repousser ces parois. Cet effet des molécules sur les parois
traduit la pression du gaz.
Les chocs des molécules d’un
gaz sont observables à l’échelle microscopique, on ne peut pas suivre chaque
molécule ( dans un verre il y a environ 1021
molécules, le paramètre macroscopique
correspondant est la pression de ce gaz.
2-3
Unité légale de pression : le pascal
Par définition, l’unité de pression, le pascal, est
la pression exercée par une force pressante d’un newton exercée sur une surface
de
Autre unité de pression très utilisée : le bar 1
bar = 100 000 Pa = 105 Pa
Comparer 1 mbar et un hectopascal ( unité très utilisée par les météorologues ).
Exemples :
|
air dans un pneu de
V.T.T. |
7 .
105 Pa |
|
air dans un pneu
d’automobile V |
3,5 .
105 Pa |
|
pression atmosphérique
à l’altitude |
7 50 hPa |
|
gaz dans une lampe à
incandescence éteinte |
100 hPa |
|
tube de télévision |
10-5
Pa |
2-4
La pression atmosphérique :
La pression atmosphérique est la pression de l’air
qui nous entoure
La pression atmosphérique varie peu jusqu’à des
altitudes de l’’ordre de la centaine de mètres, mais
change sensiblement pour des altitudes de l’ordre du millier de mètres. Elle
dépend également de l’endroit où elle est mesurée sur la surface de
Pour caractériser le temps qu’il fait et prévoir
le temps qu’il fera, les météorologistes
mesurent et analysent certaines grandeurs physiques, parmi celles-ci , la pression a une grande importance.
Sur une carte météorologique, on peut distinguer différentes
zones ( exercice n°17 p 287 ), on peut
observer :
Ø des zones de hautes
pressions : anticyclone ( beau temps )
Ø des zones de basses
pressions : dépression ( mauvais temps )
Au niveau de la mer, la pression atmosphérique moyenne est
égale à 1 013 hPa ( 101 325 Pa ), elle diminue avec l’altitude.
Lors de l’expérience avec les hémisphères de
Magdebourg, le résultat observé est lié à la différence entre la force
pressante extérieur ( due à la pression atmosphérique ) et la force résultante
due à l’air raréfié intérieur
2-5 Mesure de la
pression d’un gaz :
La pression d’un gaz se mesure avec un
manomètre (
doc 10 p 279 ).
Principe : il est souvent constitué d’une
boîte fermée avec une membrane déformable que nous mettons en relation avec le
gaz dont nous voulons mesurer la pression, cette membrane est plus ou moins
fréquemment heurtée par les molécules du gaz donc subit une force pressante
plus ou moins grande, la mesure de la déformation de la membrane est traduite
en pression. Le plus souvent on mesure la différence de pression entre le gaz
étudié et la pression atmosphérique de l’air environnant.
Il existe aussi des manomètre à
liquide par exemple pour mesurer la pression du gaz de ville arrivant au
robinet de la salle.
Expérience : la pression du gaz de ville
est-elle inférieure, égale ou supérieure à la pression atmosphérique ?
On a dans ce cas p – patm
= k . h
Pour mesurer la pression atmosphérique, on utilise
un baromètre. ( baromètre à aiguille dans un sac
fermé )
2-6 Paramètre décrivant l’état d’un gaz :
Un
verre rempli d’air renferme environ 1021 molécules de gaz en
mouvement, on ne peut pas décrire le mouvement de chacune, on ne peut que
caractériser l’état de l’ensemble des molécules par des grandeurs moyennes
dites macroscopiques
Pour décrire l’état d’un gaz, on utilise des
grandeurs macroscopiques :
·
la température mesurée à l’aide d’un thermomètre ( en °C ……) (la température rend compte de l’agitation
moyenne des molécules, ce sera l’objet d’un prochain cours : agitation
thermique, la température absolue nulle correspond à l’absence d’agitation )
·
la pression du gaz ( en Pa )
·
le volume du gaz ( en m3
)
·
la quantité de matière ( en
mol ),
on a vu en chimie que celle-ci, pour un volume donné est indépendante de la
nature du gaz ,mais dépend des conditions de température et de pression.
Un TP nous permettra de voir comment varient ces
paramètres les uns par rapport aux autres.