TP 4 (techniques d'extraction) Hydrodistillation
I PRINCIPE
1. pressage
Presser un peu
de jus d’orange. A-t-il l’odeur caractéristique de l’orange ?
Presser fortement la peau d’une orange et décrire le liquide obtenu.
2. Comment extraire le limonène de la peau du fruit ?
3. Comment récupérer les molécules odorantes ?
II- Extraction des
huiles essentielles par
entraînement à la
vapeur
Hydrodistillation
de l’huile essentielle de lavande.
L'extraction par entraînement à la vapeur est historiquement une des premières méthodes utilisées pour séparer une espèce chimique organique de son milieu naturel. Cette méthode s'utilise surtout pour les espèces chimiques odorantes des plantes, appelées huiles essentielles. Ces espèces chimiques sont généralement peu solubles dans l'eau, mais leurs vapeurs peuvent être entraînées par la vapeur d'eau.
 A - Alambic : Extraction artisanale de l'huile essentielle de lavande
A - Alambic : Extraction artisanale de l'huile essentielle de lavande
L'essence de
lavande, très utilisée en parfumerie, provient de la distillation des fleurs de
lavande, plante cultivée principalement dans les régions méditerranéennes. Sa
densité par rapport à l'eau est voisine de 0,90. Les anciens alambics
possédaient des chaudières de petite capacité (200 à
Les plantes sont placées dans la chaudière avec de l'eau. La chaudière permet l'ébullition de l'eau. La vapeur d'eau entraîne l'huile essentielle de lavande. Sous forme liquide cette essence est très peu soluble dans l'eau dont elle se sépare.
B – Au laboratoire : Montage d'hydrodistillation
Légender le montage de distillation. Expliquer ce qui se passe.
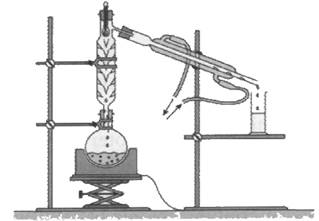 Expliquer
le rôle de chacun des éléments du montage
Expliquer
le rôle de chacun des éléments du montage
A la fin de l’étape de distillation, quel est l’aspect du contenu de l’erlenmeyer ?
Quelle technique doit-on utiliser pour séparer l'huile essentielle des autres constituants ?
données :
|
|
Eau |
Huile essentielle |
Cyclohexane |
|
Densité |
1 |
0,89 |
0,78 |
|
Solubilité dans l’eau |
- |
Faible |
Nulle |
|
Solubilité dans l’eau salée |
- |
Très faible |
Nulle |
|
Solubilité dans le cyclohexane |
Nulle |
Importante |
- |
(techniques d'extraction) Extraction de la caféine de feuilles de thé d’après Antoine Ulma(
académie de Versailles)
La caféine est une substance
chimique présente naturellement dans le thé et le café. Elle a sur l'organisme
un effet excitant. On souhaite extraire, avec un solvant, cette caféine de
feuilles de thé. Le tableau ci-dessous rassemble différentes informations sur
quelques solvants usuels.
|
Nom |
eau |
éther |
éthanol |
dichloro-méthane |
diméthyl-sulfoxyde |
|
Densité |
1,0 |
0,7 |
0,8 |
1,3 |
1,1 |
|
Température d'ébullition (°C) |
|
|
|
|
|
|
Solubilité
de la caféine à |
22 |
2,1 |
4,2 |
142 |
180 |
|
Miscibilité avec l'eau |
|
non miscible |
miscible |
non miscible |
assez miscible |
|
Pictogramme de sécurité |
|
F+ |
F |
Xn |
T |
 1 – En
utilisant les données, quel serait, selon vous, le solvant le plus efficace
pour réaliser cette extraction (à l'exclusion de toute autre considération que
l'efficacité immédiate) ?
1 – En
utilisant les données, quel serait, selon vous, le solvant le plus efficace
pour réaliser cette extraction (à l'exclusion de toute autre considération que
l'efficacité immédiate) ?
2 – En fait, on choisit plutôt l'eau pour réaliser cette extraction. On place 15g de feuilles de thé et 150mL d'eau dans un ballon, avec quelques grains de pierre ponce. On adapte ensuite un réfrigérant à eau pour faire un montage à reflux, comme sur le schéma ci-contre, et l'on chauffe pendant deux heures.
2.1 – Pourquoi préfère-t-on utiliser l'eau comme solvant et non le solvant de la question 1 ?
2.2 – Quel est l'intérêt du chauffage dans cette extraction ?
2.3 – Comment s'appelle cette technique d'extraction ?
3 – Après la période de chauffage, on laisse refroidir le montage, puis on filtre le contenu du ballon. Le filtrat contient la caféine extraite en solution dans l'eau. On place ce liquide dans une ampoule à décanter, avec 20mL de dichlorométhane, puis on agite l'ensemble et on laisse décanter.
3.1 – Dans quelle phase se trouve la caféine ?
3.2 – Justifiez le choix du dichlorométhane dans cette opération en réexaminant votre réponse au 1, dans les conditions de cette expérience.
4 – La phase contenant la caféine est récupérée, et après quelques traitements supplémentaires, on récupère 0,27g d'une poudre blanche : de la caféine pure.
4.1 – On appelle rendement brut d'une extraction le rapport de la masse de substance chimique pure extraite à la fin du processus, divisée par la masse totale de matière première utilisée (ici, des feuilles de thé). Calculez le rendement brut de cette extraction.
4.2 – Calculez le plus petit volume d'eau nécessaire pour dissoudre toute la caféine extraite.
5 – Les feuilles de thé contiennent, en moyenne, 5% en masse de caféine. Quelle est la masse maximale que l'on aurait pu espérer récupérer ?
6 – La caféine n'est pas une substance inoffensive : à forte dose, elle induit la mort par arrêt cardiaque. La dose létale (mortelle) de caféine pour un homme adulte est de 10g. Quelle masse de feuilles de thé faudrait-il manger pour en mourir ? Sachant qu'un sachet de thé contient 2,0g de feuilles, combien de sachets de thé cette dose létale représente-t-elle ?