corrigé
devoir surveillé n°1
|
Exercice1 :caractérisation d’un métal/5 données
1. Pour savoir quelle est la nature d’un
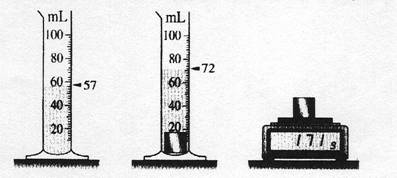
cube de métal gris blanc, on réalise les expériences suivantes. a) quel est le volume du métal en cm3? quelle est sa masse ?
V(métal) = 72 – 57 = 15 cm3 ou mL m = b) Déterminer sa masse
volumique en g.cm-3 (donner d’abord la formule littérale) r = c) Quelle est la densité
de ce métal ? (donner d’abord la formule littérale) d = d) Identifier le métal
sachant qu’il est cité dans le tableau ci-dessus Il s’agit du plomb 2. Le niveau initial de l’eau étant le
même que dans l’expérience précédente, on remplace le cube de métal précédent par 4 petites cuillères en
fer de masse respective 21,8g . Quel est le
niveau final de l’eau dans l’éprouvette quand on a
introduit les 4 petites cuillères ? m(cuillères) = 4.21,8 = r(fer) = d.r(eau) = 7,8.1 = V = Le niveau final est donc : 57
+ 11 = 68 cm3 |
|
|||||||||||||||
|
Exercice 2/4
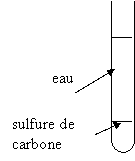
Dans un tube à essai, on a
introduit 5 mL d’eau et 2 mL de l’un des 2 solvants ci-dessus. Le schéma ci-contre
représente le contenu du tube après agitation et décantation. 1. Faire une ou plusieurs phrases
permettant de décrire l’aspect du tube à essai en employant les expressions
suivantes : solvant ;
miscible ; phase ; dense, surnager On peut dire que l’eau et le
solvant ne sont pas miscibles ; ils forment 2 phases ;
2. Quel solvant a-t-on rajouté ?
justifier la réponse. On sait qu’on a mis 5 mL d’eau et
2 mL de solvant. Donc le solvant est en dessous de l’eau et sa densité est
supérieure à celle de l’eau ( d = 1) : On a
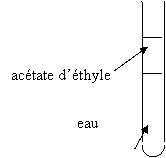
donc ajouté du sulfure de carbone. 3. Représenter l’aspect du tube à essai ( en justifiant) si l’on avait ajouté l’autre solvant non
miscible avec l’eau L’autre solvant est l’acétate d’éthyle ; il est moins dense que l’eau, il surnage. Exercice 3/5,5 On cherche à identifier les espèces chimiques
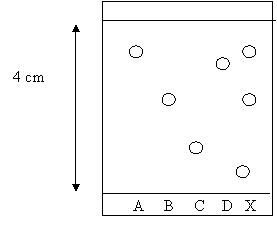
présentes dans un médicament ( noté X) . Pour cela,
on réalise une chromatographie . Les dépôts
sont : l’aspirine notée (A) ; l’acétaminophène
(B) ; la caféine (C) et la phénacétine(D). La plaque chromatographique a les dimensions
suivantes : largeur : 4,5 cm ; hauteur 5 cm ; la ligne de
dépôt est à Après élution et révélation, les résultats suivants
sont obtenus : -
Le
front de l’éluant est monté à -
Pour
les différents dépôts, on trouve :
Pour X, on trouve 3
taches dont les Rf sont respectivement à
0,13 ; 0,50 et 0,85. 1.
Faire
un schéma de la plaque de chromatographie en utilisant toutes les
informations de l’énoncé : placer en justifiant soigneusement leur
position, les différentes taches Rf = h(A) =
0,85.4 = h (B) = 0,50.4 = Pour le médicament, il y a 3 taches: h(X2) = 0,50.4 =
Que peut on dire du médicament X ? Le médicament X est composé de 3 espèces chimiques X3 a le même rapport frontal que A : c’est de l’aspirine |
|
|||||||||||||||
|
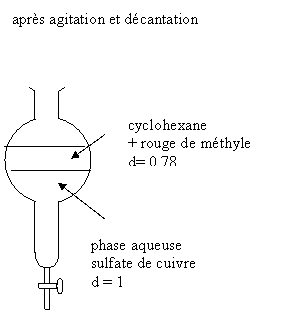
Exercice 4/5,5 On dispose d’une solution
aqueuse mauve, contenant du sulfate de cuivre et du rouge de méthyle. données à Le sulfate de cuivre est
très soluble dans l’eau ( solution bleue) mais
insoluble dans le cyclohexane. Le rouge de méthyle est peu
soluble dans l’eau ( solution rouge) mais soluble
dans le cyclohexane. 1. Définir soluble, extraction,
extraction par solvant soluble: L'espèce chimique A est
soluble dans un solvant S si elle se mélange à S en donnant une solution. extraction:procédé qui permet de
séparer une espèce chimique de son milieu initial 2. On réalise une extraction par solvant
pour séparer les 2 espèces chimiques : le sulfate de cuivre et le rouge
de méthyle initialement mélangés dans la solution mauve. Nommer la verrerie utilisée , schématiser
le déroulement de la séparation : schéma avant ; après. Commenter Il faut utiliser une ampoule à décanter
|
|