Mardi 5 Octobre 2004 DS2
Nom : prénom : TS1 et 2
L’annexe, à rendre avec la copie, est au dos de la
feuille
Attention aux chiffres significatifs dans les
résultats numériques
On étudie la
réaction d'oxydation de l'acide oxalique HOOC-COOH (solution incolore) par
l'ion permanganate ![]() (aq)
en milieu acide (solution de couleur violette). Le suivi de la réaction est
réalisé par un enregistrement spectrophotométrique.
(aq)
en milieu acide (solution de couleur violette). Le suivi de la réaction est
réalisé par un enregistrement spectrophotométrique.
1. PRÉPARATION DE
On dispose d'une solution mère
de concentration:
C0 =1,00x 10-2 mol.L-1
et du matériel suivant
- bechers de 75 mL, 150 mL ;
-pipettes jaugées de 5 mL, 10
mL, 20 mL ;
- éprouvette graduée de 50 mL, 125 mL ;
- fiole jaugée de 50 mL, 100
mL, 250 mL ;
- erlenmeyer de 250 mL.
On veut préparer 50,0
mL de
solution aqueuse de permanganate de potassium de concentration et
C1= 2,00 x 10-3 mol.L-1
Calculer en le justifiant soigneusement le volume de solution mère à
prélever et nommer la verrerie qu’il faut utiliser.
2. REACTION D'OXYDORÉDUCTION /5
La réaction met en jeu les
deux couples suivants : ![]() (aq)
/ Mn2+(aq) et CO2(aq) / H2C2O4(aq).
(aq)
/ Mn2+(aq) et CO2(aq) / H2C2O4(aq).
L'équation de la réaction
entre les ions permanganate et l'acide oxalique s’écrit:
![]() 2
2 ![]() (aq) + 5 H2C2O4(aq) + 6 H+ 10
CO2(aq) + 2 Mn2+(aq) + 8 H2O
(aq) + 5 H2C2O4(aq) + 6 H+ 10
CO2(aq) + 2 Mn2+(aq) + 8 H2O
1. On mélange V1
= 20,0 mL de la solution aqueuse de permanganate de potassium de
concentration molaire apportée C1, acidifiée par de l'acide
sulfurique, à V2 = 20,0 mL d'une solution aqueuse d'acide
oxalique de concentration molaire apportée C2 = 5 ,00 x 10-2
mol.L-1.
Quelle
est, à l'instant t =0, la quantité de matière n01 d'ions permanganate ?
2.
Quelle est, à l'instant t = 0, la quantité de matière n02 d'acide oxalique ?
3.
Calculer l'avancement maximal max. En déduire le
réactif limitant.
4. Les ions Mn2+
ne colorent pas le milieu réactionnel. Comment va évoluer la couleur du mélange
lorsque la transformation se déroule ?
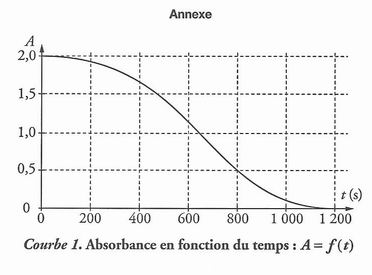
3. SUIVI
SPECTROPHOTOMÉTRIOUE /12
La transformation
chimique supposée totale étant lente, on peut suivre son évolution par
spectrophotométrie. On mesure l'absorbanceA du mélange réactionnel placé dans
la cuve du spectrophotomètre.
1.
Quelle est l'espèce chimique principalement
responsable de l'absorbance A de la solution ?
2.
Dans les conditions de l'expérience, la concentration
des ions permanganate est proportionnelle à la valeur de l'absorbanceA mesurée
(courbe 1).
L'absorbance A(t) et
l'avancement de la réaction x(t) sont reliés par la relation
x(t) = [ 2 x
10-5 -A(t) x 10-5] mol.
Par des logiciels
appropriés, on obtient la courbe 2. Les courbes sont données en annexe (à
rendre avec la copie). Elles diffèrent par leurs allures de celles que l'on
rencontre en général lors de la disparition d'un réactif dans une réaction
lente.
En quoi la courbe
A = f (t) permet-elle de retrouver le réactif limitant ?
3.
Définir ,en explicitant la formule, la vitesse
volumique de réaction en fonction de x(t) .
4.
Le volume restant constant, en comparant qualitativement
les vitesses de réaction aux dates
t1 = 100 s, t2 = 600 s et t3 = 1100 s, dire
comment évolue la vitesse au cours du temps.
5.
On refait l'expérience en modifiant uniquement la
concentration molaire apportée de la solution d'acide oxalique ![]() = 2,50 x 10-3
mol.L-1.
= 2,50 x 10-3
mol.L-1.
a. Calculer la
nouvelle quantité de matière initiale d'acide oxalique.
b. Calculer
l’avancement maximal. En déduire le réactif limitant.
c. Quelle est
l'absorbance finale ?