Présentation du spectrophotomètre et de son principe
1) Pourquoi une solution
est-elle colorée ?
La lumière blanche contient toutes les radiations visibles dont les couleurs s'étendent du rouge au violet.
Ces radiations sont caractérisées par leur longueur d'onde l dans le vide,. A une couleur donnée, il correspond une longueur d'onde donnée. Le tableau ci-dessous regroupe les différentes longueurs d'onde associées à leur domaine de couleur respectif.
|
couleur |
violet |
bleu |
vert |
jaune |
orange |
rouge |
|
Longueur d’onde (nm) |
400- 424 |
424- 491 |
491- 575 |
575- 585 |
585- 647 |
647- 750 |
Une solution est colorée si elle absorbe une partie des radiations de la lumière blanche. La couleur perçue est la couleur complémentaire de la couleur absorbée.
Le tableau ci-dessous permet d'établir la correspondance entre la longueur d'onde absorbée par la solution et la couleur perçue par l'oeil.
|
Longueur d'onde absorbée (nm) |
Couleur absorbée |
Couleur perçue |
|
400 - 435 |
violet |
jaune‑vert |
|
435 - 480 |
bleu |
jaune |
|
480 - 490 |
vert‑bleu |
orangé |
|
490 - 500 |
bleu‑vert |
rouge |
|
500 - 560 |
vert |
pourpre |
|
560 - 580 |
jaune‑vert |
violet |
|
580 - 595 |
jaune |
bleu |
|
595 ‑ 625 |
orangé |
vert‑bleu |
|
625 ‑ 750 |
rouge |
bleu‑vert |
Exemples : Une solution de permanganate de potassium est de couleur violette car elle ne transmet que les radiations dont les longueurs d’onde sont situées dans le domaine du rouge, du bleu et du violet.
Une solution de diiode transmet les radiations dont les longueurs d’onde sont situées dans le domaine du rouge, du jaune et du vert proche. Elle absorbe préférentiellement les radiations dont les longueurs d’onde sont situées dans le domaine du violet et du bleu.
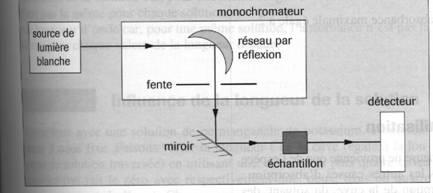
2) Le spectrophotomètre
Quel que soit le spectrophotomètre utilisé, le principe de fonctionnement est le même. La lumière blanche émise par la source est décomposée par un prisme ou un réseau .Une fente permet de sélectionner une gamme très étroite de longueurs d'onde. La lumière sélectionnée d’intensité I0 traverse une cuve dans laquelle est placée la solution à analyser (échantillon). Un détecteur permet de mesurer l'intensité lumineuse I à la sortie de la cuve.
 flux lumineux flux lumineux
flux lumineux flux lumineux
incident I0 transmis I
![]()
![]()
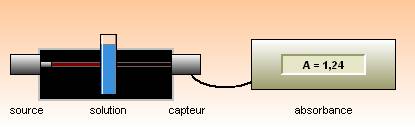
L’absorbance A mesurée par le spectrophotomètre est définie
par A = log ![]()
Elle s’exprime sans unité.
Lorsque l’absorbance est égale à 2, l’échantillon ne laisse passer qu’un centième de la lumière incidente.
3) Précautions
d’utilisation
Pour que la diminution de l'intensité lumineuse ne provienne que de l'espèce colorée à étudier, il faut éliminer toutes les autres causes d'absorption réflexion sur les parois de la cuve, absorption de la cuve, du solvant, des autres espèces contenues dans la solution... En vue de s'affranchir de tous ces paramètres, on réalise une opération appelée réglage du zéro. Elle est effectuée avec une cuve contenant le solvant et les espèces autres que celle à étudier; cette solution s'appelle un « blanc ». Cette cuve est placée dans l'appareil et une touche permet de régler la valeur de l'absorbance à zéro et d'afficher zéro sur le spectrophotomètre. Ce réglage doit être effectué chaque fois que la longueur d'onde de la lumière sélectionnée change.
différentes dates.
4). Tracé des spectres d'absorbance : Spectre de la solution d'une espèce colorée
Pour réaliser le spectre d'absorbance, courbe Al = f(l), il suffit, pour chaque valeur de la longueur d'onde, de mesurer l'absorbance de la solution colorée
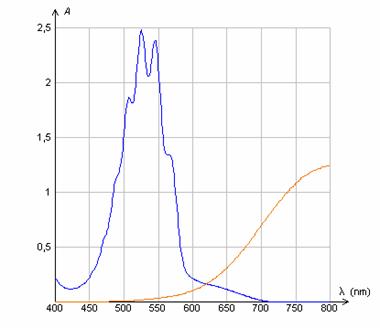
Ci-contre les spectres d’absorbance d’une solution de permanganate de potassium et d’uns solution de sulfate de cuivre à identifier.